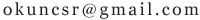等质量的镁、铁、锌,分别放入三分溶质质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图
图:
等质量的镁、铁、锌,分别放入三分溶质质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,作出判断错误的是:
A.图线X表示Mg
B.铁消耗的稀盐酸质量最大
C.镁、锌一定过量,铁可能反应完
D.镁一定过量,锌、铁可能反应完
主要就是没搞懂为什么Mg一定过量,求C.D整体分析QVQ 感谢
Mg 24,Zn 64,个人理解为24g的Mg生成2g氢气,64g的锌才能生成2g氢气
所以就是要过量的锌才能生成和镁等量的氢气……理解有错误求分析求辩解

根据金属活动顺序可知,x、y、z分别为Mg、Zn、Fe(由图可知他们与盐酸的反应速率,金属活动性越强,与酸反应越快)
相同质量的Mg、Zn、Fe与过量盐酸反应生成的氢气从多到少为Mg、Fe、Zn
由图可知Mg、Zn生成的氢气质量相同,所以Mg一定过量,Zn可能是恰好和盐酸完全反应,
铁可能反应完。消耗的稀盐酸质量最大的应该是Mg、Zn
相同质量的Mg、Zn、Fe与过量盐酸反应生成的氢气从多到少为Mg、Fe、Zn
由图可知Mg、Zn生成的氢气质量相同,所以Mg一定过量,Zn可能是恰好和盐酸完全反应,
铁可能反应完。消耗的稀盐酸质量最大的应该是Mg、Zn
温馨提示:内容为网友见解,仅供参考
第1个回答 2012-01-13
可以这么理解O__O"(其实刚刚看了好久没看懂- -)原本生成的氢气质量由大到小应该是Mg、Fe、Zn,但现在反而Fe生成的最多,【【【【Mg原本生成的氢气应该是比Fe多的,因此它一定没有反应完(即过量)】】】】】【←重点】】,但是Zn生成的氢气质量原本就应该比Fe少,所以有可能反应完也有可能没有反应完不能确定。因此C答案说Zn一定过量就不对了,但Mg一定要过量就对了。
第2个回答 2019-05-13
三个反应式一致!只是消耗的质量分别是24g,56g,65g,分别得到1g氢气需要原料12g,28g,32.5g要,由于Z高于其它所以z只能是镁,要有x=y,满足锌反应完,那么镁铁过量。如果x要代表镁那么肯定是酸不足三者中的盐酸均反应完,不可能有Z这条先出现,这么看来全错的!
相似回答